Hemoglobin (Hb) er et jernholdig metalloprotein som finnes rikelig i de røde blodcellene hos så godt som alle virveldyr. Det blir ofte hyllet som det «livsopprettholdende molekylet» på grunn av sin uunnværlige rolle i respirasjon. Dette intrikate proteinet er ansvarlig for den kritiske oppgaven med å transportere oksygen fra lungene til alle vev i kroppen og legge til rette for retur av karbondioksid for utskillelse. Å forstå dets funksjon, de elegante mekanismene som styrer dets oppførsel, og den avgjørende betydningen av klinisk måling gir et innblikk i menneskers helse og sykdom.
Funksjon og mekanisme: Et mesterverk innen molekylærteknikk
Hemoglobins primære funksjon er gasstransport. Det utfører imidlertid ikke denne oppgaven som en enkel, passiv svamp. Effektiviteten stammer fra en sofistikert strukturell design og dynamiske reguleringsmekanismer.
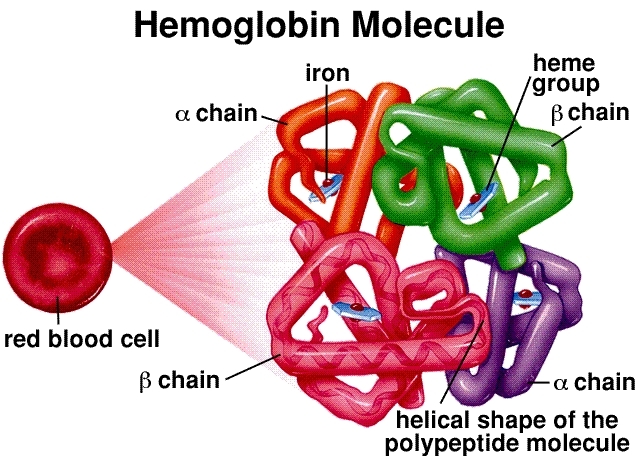
Molekylstruktur: Hemoglobin er en tetramer, bestående av fire globinproteinkjeder (to alfa og to beta hos voksne). Hver kjede er assosiert med en hemgruppe, en kompleks ringstruktur med et sentralt jernatom (Fe²⁺). Dette jernatomet er det faktiske bindingsstedet for et oksygenmolekyl (O₂). Et enkelt hemoglobinmolekyl kan derfor bære maksimalt fire oksygenmolekyler.
Kooperativ binding og sigmoidalkurven: Dette er hjørnesteinen i hemoglobins effektivitet. Når det første oksygenmolekylet binder seg til en hemgruppe i lungene (der oksygenkonsentrasjonen er høy), induserer det en konformasjonsendring i hele hemoglobinstrukturen. Denne endringen gjør det lettere for de to påfølgende oksygenmolekylene å binde seg. Det siste fjerde oksygenmolekylet binder seg med størst letthet. Denne "kooperative" interaksjonen resulterer i den karakteristiske sigmoidale (S-formede) oksygendissosiasjonskurven. Denne S-formen er avgjørende – den betyr at i det oksygenrike miljøet i lungene blir hemoglobin raskt mettet, men i oksygenfattige vev kan det frigjøre en stor mengde oksygen med bare et lite trykkfall.
Allosterisk regulering: Hemoglobins affinitet for oksygen er ikke fast; den er finjustert av vevets metabolske behov. Dette oppnås gjennom allosteriske effektorer:
Bohr-effekten: I aktive vev produserer høy metabolsk aktivitet karbondioksid (CO₂) og syre (H⁺-ioner). Hemoglobin registrerer dette kjemiske miljøet og reagerer ved å redusere sin affinitet for oksygen, noe som fører til en mer generøs frigjøring av O₂ akkurat der det trengs mest.
2,3-bisfosfoglyserat (2,3-BPG): Denne forbindelsen, som produseres i røde blodlegemer, binder seg til hemoglobin og stabiliserer dens deoksygenerte tilstand, noe som ytterligere fremmer oksygenfrigjøring. Nivåene av 2,3-BPG øker under kroniske hypoksiske tilstander, for eksempel i store høyder, for å forbedre oksygentilførselen.
Karbondioksidtransport: Hemoglobin spiller også en viktig rolle i CO₂-transport. En liten, men betydelig del av CO₂ binder seg direkte til globinkjedene og danner karbaminohemoglobin. Ved å bufre H⁺-ioner, letter hemoglobin dessuten transporten av mesteparten av CO₂ som bikarbonat (HCO₃⁻) i plasmaet.
Den kritiske betydningen av hemoglobintesting
Gitt hemoglobins sentrale rolle, er måling av konsentrasjon og vurdering av kvalitet en grunnleggende pilar i moderne medisin. En hemoglobintest, ofte en del av en fullstendig blodtelling (CBC), er en av de mest vanlige kliniske undersøkelsene. Dens betydning kan ikke overvurderes av følgende grunner:
Overvåking av sykdomsprogresjon og behandling:
For pasienter diagnostisert med anemi er serielle hemoglobinmålinger viktige for å overvåke effektiviteten av behandlingen, for eksempel jerntilskudd, og for å spore utviklingen av underliggende kroniske sykdommer som nyresvikt eller kreft.
Påvisning av hemoglobinopatier:
Spesialiserte hemoglobintester, som hemoglobinelektroforese, brukes til å diagnostisere arvelige genetiske lidelser som påvirker hemoglobinstrukturen eller -produksjonen. De vanligste eksemplene er sigdcelleanemi (forårsaket av en defekt HbS-variant) og talassemi. Tidlig oppdagelse er avgjørende for behandling og genetisk veiledning.
Vurdering av polycytemi:
Et unormalt høyt hemoglobinnivå kan indikere polycytemi, en tilstand der kroppen produserer for mange røde blodlegemer. Dette kan være en primær benmargssykdom eller en sekundær respons på kronisk hypoksi (f.eks. ved lungesykdom eller i store høyder), og det medfører en risiko for trombose.
Screening og generell helsevurdering: Hemoglobintesting er en rutinemessig del av svangerskapsomsorg, preoperative kontroller og generelle helseundersøkelser. Det fungerer som en bred indikator på generell helse og ernæringsstatus.
Diabetesbehandling: Selv om det ikke er standard hemoglobin, måler glykert hemoglobin (HbA1c)-testen hvor mye glukose som har blitt bundet til hemoglobin. Den gjenspeiler gjennomsnittlig blodsukkernivå de siste 2–3 månedene og er gullstandarden for langsiktig glykemisk kontroll hos diabetespasienter.
Konklusjon
Hemoglobin er mye mer enn en enkel oksygenbærer. Det er en molekylær maskin med utsøkt design, som bruker samarbeidende binding og allosterisk regulering for å optimalisere oksygentilførselen som svar på kroppens dynamiske behov. Følgelig er klinisk måling av hemoglobin ikke bare et tall på en laboratorierapport; det er et kraftig, ikke-invasivt diagnostisk og overvåkingsverktøy. Det gir et uunnværlig øyeblikksbilde av en persons hematologiske og generelle helse, noe som muliggjør diagnostisering av livsendrende tilstander, overvåking av kroniske sykdommer og bevaring av folkehelsen. Forståelse av både dets biologiske geni og dets kliniske betydning understreker hvorfor dette beskjedne proteinet fortsatt er en hjørnestein i fysiologisk og medisinsk vitenskap.
Publisert: 17. oktober 2025